Signification du pH

En aquaculture, cette considération est particulièrement importante, car elle peut avoir un impact drastique sur la production des poissons, crustacés et autres animaux aquatiques. De fait, l’eau est l’environnement dans lequel ils évoluent et ses paramètres ont une répercussion directe sur le développement et la qualité de ces animaux.
Je me souviens encore d’une pisciculture visitée, il y a fort longtemps, dans le sud de l’Europe. Elle se situait dans une cuvette et on y élevait des daurades qui inondaient la ville voisine. Non loin de là, sur la hauteur, une industrie chimique émettait souvent par ses hautes cheminées une fumée fort épaisse de couleur ...rousse ! Et lorsque le vent soufflait, elle rabattait fréquemment toutes ces fumées polluées en contre-bas ...vers la pisciculture ! Ainsi, pendant plusieurs jours, durant de longues heures, la surface de l’eau dans les étangs absorbait passivement toute cette pollution. A force de contact, l’eau étaient devenue plus acide et les poissons ne croissaient pas bien ! Indiscutablement, il y avait là un très gros problème de production ...sans compter sur une très forte probabilité que la chair de ces daurades ne pouvait pas offrir une saveur idéale pour la consommation… A l’époque, le lobby industriel en amont ignorait les règles les plus élémentaires pour la protection de l’environnement... avec de toute évidence l’approbation implicite des autorités régionales (élus politiques) devant s’y retrouver dans leurs projections économiques et budgétaires !
Le pH implique à la fois des notions de chimie (ions), mathématique (logarithmes) et physique (potentiels électriques). Sur le terrain, on l’estime facilement au moyen d’un pH-mètre.

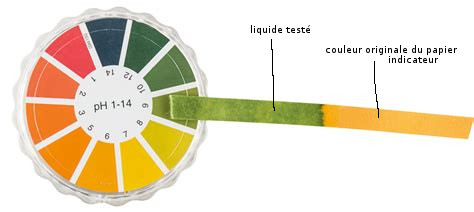
On utilise également un petit rouleau de papier indicateur universel qui trempé dans le liquide (dans notre cas, l’eau des bassins) change de couleur en indiquant le pH par simple comparaison avec un spectre de couleurs comme référence.

Enfin, au laboratoire, on est plus précis en déterminant le pH par quelques réactions chimiques.

Mais en quoi consiste réellement le pH ?
p vient de potentiel et H de l’hydrogène.
C’est la mesure de l'état acido-basique d'une solution contenant des ions H+.
Elle est définie par pH comme étant le − log10 [H+], où [H+] est la concentration de la solution en ions H+ 1.
L’usage du pH qui exprime la concentration de l’ion hydrogène a son origine dans l’ionisation de l’eau pure 2,
H2O = H+ + OH-.
A 25°C, l’expression de l’équilibre pour l’ionisation de l’eau est :
[H+] [OH-] / [H2O] = Kw = 10-14 (Kw étant la constante d’équilibre à une température donnée).
L’ionisation ne réduit pas considérablement la concentration de l’eau en solution aqueuse, par conséquent H2O peut être regardé comme une unité et l’expression pour l’ionisation de l’eau écrite par :
[H+] [OH-] = Kw = 10-14.
La concentration en ion hydrogène dans l’eau pure égale celle de l’ion hydroxyle, de manière que
[H+]2 = 10-14
[H+] = 10-7.
De même, [OH-] doit aussi être égal à10-7 mole/litre 3, du fait que
[OH-] = 10-14 / [H+] = 10-14 / 10-7 = 10-7.
A la place d’utiliser de petits nombres nécessairement pour exprimer l’acidité ou l’alcalinité (basicité) en mole/litre d’ions hydrogène et hydroxyle, il est préférable d’utiliser le pH. Le pH d’une solution est défini par le logarithme négatif de sa concentration en ion hydrogène
pH = -log [H+].
L’eau pure est neutre étant donné que [H+] = [OH-] et son pH est 7, parce que
pH = -log[10-7] = 7.
Evidemment, si l’eau est rendue plus acide par addition d’H+, [H+] doit augmenter et [OH-] diminuer de sorte que Kw reste 10-14. Par conséquent, le pH diminue quand l’acidité augmente. En suivant le même raisonnement, si [OH-] est ajouté à l’eau, [H+] va diminuer et le pH va augmenter.
Le pH d’une solution peut ainsi être calculé à partir de [H+]. Si la concentration en ion hydrogène de la solution est de 0,001 M, c’est-à-dire de 10-3 M, son pH est évidemment 3. Le calcul est un peu plus difficile si la concentration en ion hydrogène n’est pas égal à 1 multiplié par une puissance de 10.
Exemple : Quel est le pH d’une solution dans laquelle la concentration d’ion hydrogène est de 0,003 M ?
Solution : pH = -log[3x10-3]
= -(log 3+ log 10-3)
= -(0,47 + -3)
= -(-2,53)
= 2,53
La [H+] peut être calculé depuis le pH. Quand le pH = 5, on peut tout de suite voir que [H+] = 10-5. Le calcul n’est même pas difficile pour les valeurs fractionnées de pH.
Exemple : Le pH d’une eau naturelle est 6,73, calculez [H+].
Solution : [H+] = 10-6,73
= 100,27 x 10-7
= 1,86 x 10-7 mole/litre
En calculant [H+] du pH dans l’exemple ci-dessus, vous savez tout de suite que [H+] doit se trouver entre 10-6 et 10-7, de façon que [H+] sera un nombre multiplié par 10-7.
Pensez que pH 6,73 comme résultant de l’addition du logarithme 0,27 au logarithme -7. Par conséquent, l’anti-logarithme de 0,27 multiplié par 10-7 est la concentration en ion hydrogène.
Références :
-
Water quality, Claude E. Boyd (lecture/cours), Dept.of Fisheries and Allied Aquacultures, Auburn University, Agricultural Experiment Station, Alabama, U.S.A., 1981.
-
www.britannica.com
-
www.cnrtl.fr
-
www.dictionnaire.lerobert.com
______________________
1 log10 est le logarithme en base 10 ; c’est la puissance à laquelle il faut élever une constante appelée base pour obtenir un nombre donné; un logarithme est juste la fonction opposée d’une exponentiation ; le logarithme d'un produit est la somme des logarithmes de ses facteurs ...en d’autres termes c’est prendre le logarithme au lieu d'utiliser directement la somme pour traiter de très grandes valeurs (en fait, les logarithmes abrègent les opérations de l'arithmétique).
2 Les ions d’hydrogène sont solvatés (dissous) et apparaissent dans la solution aqueuse H3O+ ou (H2O) x H+. Par mesure de simplicité, on utilisera H+ en référence aux ions d’hydrogène.
3 En chimie, la mole est l’unité scientifique standard dans le Système International des unités (SI) pour mesurer de très grandes quantités de toutes petites entités, comme les atomes , les molécules ou d’autres particules spécifiques. La mole désigne la constante d’Avogadro = 6,02214076 × 1023. En d’autres mots, des volumes de gaz soumis à de mêmes conditions contiennent la même quantité de molécules. Ceci permet d’être très utile pour la détermination des poids atomiques et moléculaires et conduit au concept de mole. Cette notion est particulièrement importante pour quantifier l’information dans les équations chimiques au niveau macroscopique - Prenons un exemple : dans la réaction chimique 2H2O → O2 + 2H2, deux moles d’eau (H2O) sont décomposées en deux moles d’hydrogène moléculaire (H2) et d’une mole d’oxygène moléculaire. La mole peut-être utilisée pour déterminer la formule la plus simple d’un composé et calculer les quantités mis en jeu dans les réactions chimiques. Lorsqu’on a affaire à des réactions qui ont lieu dans des solutions, le concept en relation avec la molarité est pratique : la molarité (M) est définie par le nombre de moles de soluté (élément ou corps dissout) dans un litre de solution (mole/L).